СЕМИОТИКА НЕКОТОРЫХ ЗАБОЛЕВАНИЙ ЭНДОКРИННЫХ ЖЕЛЕЗ Эндокринные железы, обладающие внутрисекреторной функцией, включают гипофиз, эпифиз, надпочечники, щитовидную, паращитовидные, вилочковую, поджелудочную и половые железы. Каждая из них выполняет специфическую функцию, но все они находятся, в тесной взаимосвязи друг с другом и с ЦНС, обеспечивая единство организма, что отражается термином «нейроэндокринная (нейрогуморальная) регуляция». Часто в развитии патологического процесса выявляется взаимозависимое нарушение функций различных эндокринных желез. Интегрирующим центром, который обеспечивает регуляцию и взаимодействие нейроэндокринных импульсов, стимулируя выработку тропных или тормозных гормонов, является гипоталамус. Между эндокринными железами существуют тесные коррелятивные связи. Они оказывают влияние на все виды обмена веществ, а также рост, физическое и умственное развитие. Инкреторные железы у детей являются регуляторами процессов роста и развития ребенка. Гормоны действуют на генетический аппарат клеток и таким образом участвуют в осуществлении генетической программы развития, проявляющейся в фенотипической дифференцировке органов и организма в целом. В биосинтезе и метаболизме многих гормонов у новорожденных и детей раннего возраста имеются особенности, свидетельствующие о функциональном несовершенстве эндокринных желез и обменных процессов. В различные периоды детства может выявляться относительное превалирующее влияние определенной эндокринной железы. Ко времени рождения эндокринная система контролируется ЦНС, то есть уже функционирует единая нейроэндокринная система регуляции, и после рождения ребенка она продолжает интенсивно развиваться и совершенствоваться. В связи с этим у детей в отличие от взрослых эндокринные расстройства могут вызывать непоправимые изменения в растущем организме. При обследовании детей прежде всего обращается внимание на отклонения в соматическом и половом развитии. Очень важно собрать тщательный генеалогический анамнез, так как ряд заболеваний могут быть у родственников (карликовость, гигантизм, сахарный диабет и др.). Анамнез заболевания также должен быть полным. Важно учитывать все факторы, влияющие на плод и ребенка, течение родов. Подробно выясняются характер развития статики и моторики на 1-м году жизни, характер вскармливания, оценивается последующее развитие. При этом необходимо учитывать, что некоторые заболевания эндокринных желез могут протекать латентно и их можно выявить лишь специальными методами исследования. СЕМИОТИКА НАРУШЕНИЙ РОСТА. Под термином «рост» подразумевается изменение размеров тела или уровней зрелости организма ребенка, установленных при определенных измерениях. Рост ребенка определяется взаимодействием многих факторов. Генетические факторы, влияющие на темп и окончательный предел биологического потенциала, тесно связаны с внеш-несредовыми факторами. Травма пренатальная или постнатальная, нарушающая рост и развитие, может быть химической, физической, иммунологической или являться результатом инфекции. Факторы питания, влияющие на рост (полноценные белки, соли, микроэлементы, витамины и др.), могут быть тесно связаны с социально-экономическими факторами. Социальные и эмоциональные факторы, которые могут изменять ростовой потенциал, включают положение ребенка в семье, характер его взаимоотношений с родителями, воспитания, индивидуальные интересы и потребности родителей. Таким образом, рост и развитие ребенка являются результатом сложного сочетанного влияния на него многих факторов. Достигаемые при этом показатели уникальны для каждого ребенка и колеблются в определенных пределах, что обозначается термином «норма». Раннее распознавание физических и эмоциональных нарушений развития и их коррекция зависят от тщательной регистрации показателей физического развития у детей. У большинства доношенных детей масса тела (средняя масса при рождении 3—3,5 кг) восстанавливается к 7—10-му дню после рождения, удваивается к 5-месячному возрасту и утраивается к 10—12-му месяцу. Длина тела у детей первого года жизни определяется с учетом ежемесячного ее увеличения. Допустимые пределы колебаний ± 4 см. В норме рост ребенка (средняя длина при рождении 50—54 см) в течение 1 -го года жизни увеличивается на 25 см (16—17 см в первые 6 мес жизни и около 8 см в последующие 6 мес). В течение 2-го года жизни отмечается уменьшение скорости роста ребенка: в среднем его масса тела увеличивается на 2,5 кг, а рост на 10—12 см. На 3, 4 и 5-м годах жизни увеличение массы тела и роста происходит относительно равномерно и составляет около 2 кг и 6—8 см в год соответственно. Большинство детей в этом возрасте худеют. С 5-го поЮ-й год жизни (до пубертатного периода) рост увеличивается в среднем на 5—6 см в год. Масса тела в этот промежуток времени возрастает в среднем на 3—3,5 кг в год. Подростковый период характеризуется значительным увеличением скорости роста. Он начинается в возрасте около 10 лет у девочек и 12 лет у мальчиков. Ускорение роста у мальчиков начинается в возрасте между 13—15 годами. В течение этого времени рост увеличивается на 20—25 см, 10 из которых приходится на год наибольшего его ускорения. У девочек ускорение роста начинается на 1—2 года раньше, чем у мальчиков, и почти заканчивается к 13 годам; в год максимальной скорости роста этот показатель достигает 8 см. После этого пика скорость роста замедляется, и к возрасту 18 лет он почти заканчивается. Оценка роста и развития ребенка приносит наибольшую пользу только в том случае, если проводится тщательно и в каждом периоде, в котором могут наблюдаться изменения. В центильных таблицах представлены показатели роста и массы тела детей в зависимости от возраста. Нормальный (средний) рост: показатели роста отклоняются от средних величин не более ±15 и входят в интервал 25—75-й процентили. Низкий рост: ниже средних для данного возраста величин более -2, -38, или ниже 10—5-й процентили, что соответствует отклонению от них на 10 %. Карликовый рост: показатели роста ниже средних на -3S и соответственно ниже 5-й процентили. Большой рост, макросомия: показатели роста превышают средние на 2—38, или оказываются в пределах 90—97-й процентили. Гигантский рост, гигантизм: показатели роста превышают средние более чем на 38, или оказываются выше 97-й процентили. С учетом допустимых колебаний кривая роста у здорового ребенка достаточно ровная, поэтому любое существенное отклонение линии роста, вероятнее всего, обусловлено болезнью, нарушением питания или неблагоприятными психосоциальными условиями. СЕМИОТИКА ЗАДЕРЖКИ РОСТА. Задержка роста является частой причиной обращаемости к эндокринологу: около 3 % детей имеют выраженную задержку роста. При этом дефицит гормона роста как причина низкорослости выявляется не более чем у 8,5 % из них. У остальных детей наиболее часто выявляются конституциональные особенности роста и развития, реже — дефицит других анаболических гормонов, тяжелые соматические заболевания, генетические и хромосомные заболевания. Схема оценки физического развития детей по центильным таблицам
Принято различать эндокриннозависимые и эндокринноно-зависимые формы задержки роста. Эндокриннозависимые варианты задержки роста. Наиболее тяжелые нарушения процессов роста наблюдаются при патологии эндокринной системы. Известно, что многие гормоны (соматотропный, тиреоидные, половые, глюкокортикоиды, инсулин и др.) непосредственно или пермиссивно участвуют в процессах роста. Наиболее выраженный ростовой эффект дает соматотроп-ный гормон (СТГ, соматотропин, гормон роста). СТГ — это белок, состоящий из 191 аминокислотного остатка и кодируемый геном 17-й хромосомы. По структуре гормон роста на 85 % гомологичен хорионическому соматомаммотропину и на 26 % — пролактину. В отличие от других гормонов гипофиза он относительно видоспецифичен: в отношении человека эффективен только гормон роста приматов. СТГ, применяющийся для лечения детей с его недостаточностью, в настоящее время синтезируется с помощью рекомбйнантной ДНК. В организме СТГ синтезируется и депонируется соматотрофами аденогипофиза. Секреция СТГ имеет пульсирующий характер с выраженным суточным ритмом. Основное количество СТГ образуется в ночное время, в начале глубокого сна, что особенно выражено в детстве. Секреция соматотропина стимулируется СТГ-рилизинг-гормоном (соматолиберином) и тормозится СТГ-ингибирующим фактором (соматостатином). Их эффекты опосредуются гипоталамическими нейротрансмиттерами (дофамином, норадреналином, серотонином и др.). Поэтому психический стресс, и особенно дистресс, физические перегрузки, прием многих лекарственных средств изменяют оптимальную и синхронизированную активность нейротрансмиттеров гипоталамуса, вследствие чего нарушается секреция соматостатина и соматолиберина и в результате — секреция СТГ. СТГ является основным гормоном, стимулирующим линейный рост. Он способствует росту костей в длину, росту и диффе-ренцировке внутренних органов, развитию мышц. СТГ стимулирует липолиз (снижая массу жировой ткани), гликонеогенез, синтез белка, увеличивает мышечную массу и силу, всасывание кальция и фосфора в кишечнике и оссификацию костей. Показано усиление сократимости миокарда и скорости клубочковой фильтрации под влиянием соматотропина. Ростостимулирующие эффекты СТГ опосредуются через соматомедины или инсулиноподобные факторы роста (ИФР-1, ИФР-2), которые синтезируются главным образом в печени и почках под влиянием СТГ. ИФР стимулируют пролиферацию и дифференцировку хондробластов, обеспечивая рост кости в длину. Соматомедины циркулируют в плазме в связанном со специфическими белками-носителями виде. Известно 6 классов этих белков. Наиболее важным из них является ИФРСБ-3, который связывает около 90 % всех ИФР у детей и взрослых. Уровень ИФР-1 и ИФРСБ-3 отражает суммарную секрецию СТГ. Стимулирующее влияние на секрецию СТГ оказывают тире-оидные и половые гормоны, вазопрессин, адренокортикотропный, меланоцитостимулирующий гормоны. Глюкокортикоиды при острой нагрузке оказывают стимулирующее действие; при длительном хроническом избытке гормона секреция СТГ практически полностью подавляется. Тиреоидные гормоны в физиологических количествах дают значительный анаболический эффект. В отличие от СТГ эти гормоны в большей степени влияют на дифференцировку (созревание) тканей, прежде всего костной. В то же время тиреоидные гормоны, активно влияя на уровень гормона роста, ускоряют и линейный рост ребенка. Инсулин играет важную роль в регуляции процессов роста, так как, с одной стороны, обеспечивает анаболические процессы энергетически, с другой — непосредственно усиливает синтез белка. Половые гормоны обладают мощным анаболическим действием, ускоряя как линейный рост, так и дифференцировку костей скелета. Однако следует помнить, что ростовой эффект половых гормонов осуществляется лишь в присутствии СТГ. Влияние эстрогенов на процессы роста доказано в настоящее время не только у девочек, но и у мальчиков на основе сверхчувствительных методов их определения. Минимальные уровни эстрогенов у детей обоего пола стимулируют ростовой скачок, высокие уровни ускоряют эпифизарное созревание и прекращают линейный рост. Глюкокортикоиды, усиливая процессы гликонеогенеза, оказывают выраженное катаболическое действие. Отрицательное влияние на процессы роста оказывает кортизол в больших дозах, потому что активно тормозит выделение соматотропина. Таким образом, задержка роста и отставание костного возраста являются симптомом многих эндокринных заболеваний, для которых характерен дефицит анаболических или избыток катаболических гормонов. Церебрально-гипофизарный нанизм (ЦГН) характеризуется выпадением функций всех тропных гормонов (пангипопитуита-ризм). Различаются идиопатический и органический варианты заболевания. При идиопатическом варианте ЦГН признаки органического поражения ЦНС отсутствуют, патологический процесс формируется на уровне гипоталамических структур. Встречается у 1 из 10—15 тыс. детей, у мальчиков в 2—4 раза чаще, чем у девочек. Выявлена определенная связь заболевания с рождением ребенка в ягодичном предлежании, с помощью щипцов, с кровотечением в родах. Все это свидетельствует о роли родовой травмы и гипоксии в генезе ЦГН. Клиническая картина заболевания обусловлена дефицитом тройных гормонов и нарушением в силу этого функции эндокринных желез. При этом доминируют симптомы дефицита СТГ, то есть имеет место выраженная пропорциональная задержка роста. При отсутствии лечения рост взрослых больных не превышает 120 см у женщин и 130 см у мужчин. При рождении и в первые месяцы жизни физическое развитие детей с ЦГН не отличается от такового у здоровых детей. Задержка роста становится заметной на 2-м году жизни. Постепенно темпы роста снижаются, и после 4 лет жизни дети прибавляют в год не более 2—3 см. Костный возраст значительно отстает от хронологического. Помимо задержки роста у детей с дефицитом СТГ имеется склонность к гапогликемическим состояниям (снижены процессы гли-когенолиза). Гипогликемия у некоторых детей может быть первым признаком заболевания и нередко выявляется уже в период новорожденное. Дефицит тиреотропного гормона (ТТГ) у больных с ЦГН является прлчиной гипотиреоза, что определяет комплекс характерных симптомов: психическая вялость, сухость кожных покровов, брадикардия, гипотония, запоры, позднее появление и поздняя смена зубов. Выраженный дефицит ТТГ еще более ухудшает процессы роста и дифференцировки костей скелета у больных с ЦГН. Дефицит гонадотропных гормонов (ГТГ) является причиной развития гипогонадизма. У части мальчиков с ЦГН уже при рождении имеются признаки внутриутробного дефицита ГТГ: крипт-орхизм и микрофаллос. В дальнейшем у всех больных выявляются симптомы тяжелого гипогонадизма: вторичные половые признаки отсутствуют, зоны роста остаются открытыми. Выраженный дефицит половых гормонов и отсутствие вследствие этого пубертатного скачка в росте у таких детей еще более усугубляют задержку роста. У большинства больных ЦГН наблюдаются дефицит АКТГ и гипокортицизм, однако вне стрессовых ситуаций симптомы гипокортицизма у больных, как правило, не проявляются. На фоне терапии тиреоидными и анаболическими препаратами потребность в глюкокортикоидах возрастает и могут выявляться симптомы надпочечниковой недостаточности, чаще — в ответ на стрессовую ситуацию. При органическом варианте ЦГН может иметь место повреждение гипоталамо-гипо-физарной системы вследствие врожденных дефектов (аплазия или гипоплазия, аневризма) или деструктивных повреждений: в перинатальный период — родовая травма, гипоксия, геморрагический инфаркт, травматические повреждения головы, переломы основания черепа. Однако наиболее часто у таких больных выявляется врожденная опухоль — краниофарингиома, могут быть и другие новообразования (гистиоцитоз X, герминома, глиома зрительного тракта, аденомы гипофиза). Помимо задержки роста у больных с органическим вариантом ЦГН обращают на себя внимание выраженная неврологическая симптоматика, признаки повышения внутричерепного давления, ограничение полей зрения, атрофия и отек дисков зрительного нерва, параличи и парезы мышц, иннервируемых черепными нервами. По мере прогрессирования процесса и выпадения функций других тропных гормонов появляются симптомы гипотиреоза, гипокорти-цизма, гипогонадизма. Атрофия коры надпочечников, щитовидной и половых желез приводит к резкому похуданию, астении, повышенной чувствительности к холоду, замедленности умственной деятельности и отсутствию потоотделения. Половое созревание не наступает, а если уже началось, то регрессирует. В результате может развиться атрофия гонад и половых путей с аменореей и выпадением волос в области лобка и подмышечных впадин. Выражена тенденция к развитию гипогликемии, вплоть до комы. На ранних стадиях возможен несахарный диабет, но по мере деструкции передней доли гипофиза он спонганно исчезает. Облучение опухолей ЦНС, глаз и среднего уха, так же как и облучение черепа при остром лейкозе, может обусловить гипо-таламогипофизарные нарушения. При этом чаще всего развивается недостаточность СТГ, но возможна и недостаточность тиреотропного гормона гипофиза, АКТГ и гонадотропинов. Первые клинические признаки могут появляться спустя длительное время после облучения. Изолированный дефицит СТГ. При изолированном дефиците СТГ другие тропные гормоны выделяются в нормальных количествах, в связи с чем наблюдается более благоприятное течение заболевания: рост взрослых больных несколько выше, чем при ЦГН (у женщин — 125 см, у мужчин — 145 см), симптомов гипотиреоза нет, половое созревание наступает обычно на 2—4 года позже, но протекает нормально, больные, как правило, фертильны. Костный возраст отстает от хронологического, но дифференцировка костей скелета нарушается в меньшей степени, чем при ЦГН. По окончании пубертатного периода зоны роста у больных закрываются. В настоящее время известны еще три варианта изолированного дефицита СТГ: частичный дефицит гормона роста, селективный дефицит гормона роста и психологическая карликовость. Частичный дефицит СТГ встречается примерно у 10 % больных с изолированным дефицитом СТГ. Этот вариант заболевания характеризуется неполным выпадением функций гормона роста и более легким клиническим течением заболевания. Нейросекреторная дисфункция характеризуется нарушением регуляции синтеза СТГ и снижением в силу этого спонтанной секреции соматотропина. При этом может нарушаться лишь один из регуляторных механизмов (катехоламиновый, серотониновый или допаминовый). Психологическая (депривационная) карликовость может иметь место у детей из неблагополучных семей. У них развиваются выраженная задержка роста, отставание костного возраста, психического развития, доказано наличие дефицита гормона роста. Для обделенных душевным теплом детей характерны извращенный аппетит или прожорливость, недержание мочи и кала, бессонница, судорожный крик и внезапные вспышки гнева. Они бывают чрезмерно пассивными или агрессивными, а их интеллект находится на нижней границе нормы или снижен. При изоляции этих детей от неблагоприятных условий уровень СТГ самостоятельно восстанавливается, дети начинают расти, однако отставание интеллектуального развития остается на всю жизнь. Редкий вариант задержки роста— синдром Ларона — обусловлен дефектом рецепторов СТГ. Клиническая картина у больных с подобным синдромом идентична клинической картине изолированного дефицита СТГ. Однако уровень в плазме биологически активного гормона роста повышен. Отсутствие эффекта гормона роста объясняется снижением уровня соматомединов (прежде всего ИФР-1), синтез которых не повышается при введении экзогенного соматотропина. Описаны семейные случаи заболевания, часто в таких семьях регистрируются кровнородственные браки. Заболевание наследуется по аутосомно-рецессивному типу, но возможны и спорадические случаи. Нельзя исключить возможность развития задержки роста у детей, обусловленной также нарушением биологической активности СТГ. Помимо дефицита СТГ (или нарушения механизма его действия) выраженная задержка роста у детей может быть обусловлена дефицитом и других анаболических гормонов (тиреоидных, половых, инсулина). Так, для больных гипотиреозом, гипогона-дизмом (в подростковом возрасте) и синдромом Мориака (при тяжелом течении сахарного диабета) характерны задержка роста и отставание костного возраста. Выраженная низкорослость как результат преждевременного закрытия зон роста всегда имеет место у больных с преждевременным половым созреванием любой этиологии. Высокий уровень глкжокортикоидов, как ятрогенный, так и эндогенный (болезнь, синдром Иценко—Ку-шинга), также приводит к нарушению процесса линейного роста. Механизм основан на непосредственном нарушении метаболизма, в том числе повышении катаболизма белков для получения энергии, уменьшении липолиза и снижении синтеза коллагена. Глкжокортикоиды также оказывают угнетающее воздействие на продукцию гормона роста, повышая содержание соматоста-тина и подавляя интермиттирующее высвобождение СТГ. Кроме того, они подавляют продукцию ИФР-1. Результатом всех этих процессов является тот факт, что большинство детей с избытком стероидов имеют небольшой рост. В типичных случаях у них увеличено отношение веса к длине тела и развивается ожирение. В отличие от взрослых больных с синдромом Иценко-Кушинга у детей ожирение обычно развивается пропорционально; кроме того, отличительным признаком такого заболевания является мышечная слабость. Сложность при дифференциальной диагностике нарушений роста при этих состояниях может возникнуть лишь в том случае, когда у больного с легким вариантом первичного врожденного гипотиреоза имеют место пропорциональная задержка роста и отставание костного возраста (моносимп-томный вариант заболевания) и нет других типичных симптомов врожденного гипотиреоза. Особенности гормонального профиля этих заболеваний позволяют без труда установить правильный диагноз. Повышение уровня ТТГ и нормальный на фоне стимуляции уровень СТГ (после насыщения ТГ) позволяют исключить у больного дефицит СТГ как причину задержки роста и установить диагноз первичного гипотиреоза (моносимптомный вариант). Псевдогипопаратиреоз (синдром Олбрайта) также можно отнести к эндокриннозависимым вариантам задержки роста. При этом синдроме паращитовидные железы гистологически нормальны и способны синтезировать и секретировать паратгормон. Заболевание обусловлено наследственным дефектом рецепторных тканей, в частности почек и скелета, клетки-мишени резистентны к действию паратгормона. Для больных псевдогипопарати-реозом характерны низкорослость, возникающая в возрасте после 3—4 лет, короткая шея, короткие и широкие фаланги пальцев, брахидактилия, чаще всего 1, 4, 5-й пястных костей, а также 1-й и 5-й плюсневых; экзостозы и утолщение свода черепа, генерализованная деминерализация костей. У таких больных нередко обнаруживаются отложения кальция и метапластическое образование костной ткани под кожей. Часто отмечаются умственная отсталость, кальцификация базальных ганглиев и катаракта. Подтверждением диагноза служат гипофосфатурия и гипокальциемия, низкий уровень паратгормона в крови. Эндокриннонсзависимые варианты задержки роста. Значительно чаще у больных с задержкой роста признаки нарушения функции эндокринных желез отсутствуют, то есть у большинства детей задержка роста обусловлена неэндокринными факторами. Тяжелые соматические заболевания, в результате которых возникают состояния длительной гипоксии (врожденные пороки сердца, анемия, заболевания легких), нарушения всасывания (целиакия, муковисцидоз), тяжелые метаболические нарушения (хронические заболевания печени и почек), а также патология костной системы (хондродистрофия, гаргоилизм и другие врожденные синдромы) часто сопровождаются выраженной задержкой роста. При данных вариантах нанизма признаки первичного нарушения функции эндокринных желез отсутствуют, костный возраст, как правило, соответствует хронологическому. На первый план выступают симптомы основного заболевания, что позволяет без труда установить причину задержки роста. Конституциональная задержка роста — самая частая проблема, с которой сталкивается педиатр. Конституциональная задержка роста и полового созревания — синдром позднего пубертата — характеризуется особенностями роста и развития наследственного характера, встречается примерно у 2 % детей, чаще у мальчиков. Обычно родители и (или) ближайшие родственники этих детей имеют те же особенности развития. Так, длина и масса тела при рождении не отличаются от таковых у здоровых детей. Наиболее низкие показатели темпов роста имеют место в первые годы жизни, и, следовательно, наиболее выраженная задержка роста наблюдается у детей в возрасте 3—4 лет. С 4—5-летнего возраста темпы роста восстанавливаются (5—6 см в год), однако, имея исходно низкий рост, дети остаются в школьном возрасте низкорослыми. Костный возраст несколько (в среднем на 2 года) отстает от хронологического. Этим обстоятельством можно объяснить позднее вступление в пубертат: обычно половое развитие и, следовательно, пубертатный скачок в росте запаздывают у этих детей на 2—4 года. В связи с этим подростки с синдромом позднего пубертата временно отстают в своем развитии (по показателям физического развития) от сверстников. Позднее вступление в пубертат в данном случае следует признать благоприятным фактором, так как оно позволяет пациентам с подобными особенностями конституционального развития иметь в конечном итоге нормальный рост. При проведении дифференциальной диагностики вариантов задержки роста у мальчиков следует помнить, что около 80 % подростков с задержкой роста и полового развития имеют эту конституциональную особенность роста и развития. Семейная низкорослость. Среди родственников детей с подобным вариантом задержки роста всегда имеются низкорослые. При рождении дети имеют нормальные показатели роста и массы тела, но темпы роста в возрасте после 3—4 лет составляют 2—4 см в год. Костный возраст этих детей обычно соответствует хронологическому, и, следовательно, вступление детей в пубертат соответствует нормальным срокам. Данное обстоятельство является причиной низкорослости взрослых пациентов с этими особенностями развития. Нельзя исключить, что причиной семейной низкорослости являются конституциональные особенности синтеза и секреции гормона роста. Примордиальный (внутриутробный, первичный) нанизм. Особенностью данного варианта задержки роста является нарушение процессов роста с периода внутриутробной жизни. Доношенные новорожденные с этой патологией имеют недостаточную длину и массу тела. На всех этапах жизни дети с примордиальным нанизмом значительно отстают от своих сверстников в росте. Однако в отличие от детей с эндокриннозависимой задержкой роста костный возраст у этих детей соответствует хронологическому, пубертатный период, как правило, наступает в обычные сроки. Уровень СТГ соответствует нормальным показателям. Не вызывает сомнения факт, что группа детей с примордиальным нанизмом гетерогенна. В эту группу больные объединяются по одному главному признаку — нарушению процессов роста с периода внутриутробной жизни (генетические синдромы Рассела-Сильвера, Секкеля и др., внутриутробная инфекция (краснуха, сифилис, токсоплазмоз, цитомегалия), «плод алкоголика» и др.). Для больных синдромом Рассел а-С ил ьвера характерны низкорослость, нависание лба, маленькое треугольной формы лицо, почти полное отсутствие подкожно-жировой клетчатки, укорочение и искривление 5-го пальца; во многих случаях отмечается асимметрия лица. Уровень СТГ обычно не отличается от нормы, однако в единичных случаях может встречаться недостаточность гормона роста. Основными признаками синдрома Секкеля (карликовость с «птицеголовостью») являются дефицит длины и массы тела при рождении, микроцефалия, узкое лицо, большой клювовидный нос, редкие волосы, низко посаженные деформированные ушные раковины, ретрогнатия, аномалии скелета; характерна умственная отсталость. Из аномалий половых хромосом к низкорослости может привести синдром Шерешвеского— Тернера. При классическом варианте синдрома (кариотип 45,ХО) рост взрослых больных не превышает 142—145 см, при мозаицизме (кариотип 45,ХО/46,ХХ) рост может быть несколько выше. При рождении дети с этим синдромом имеют нормальные показатели длины и массы тела, задержка роста начинает обращать на себя внимание с 2—3-летнего возраста. С этого времени темпы роста снижаются до 2—3 см в год. Костный возраст, как правило, до 11 — 12 лет соответствует хронологическому, в дальнейшем из-за выраженного гипогонадиз-ма отстает от хронологического. При классическом варианте заболевания вторичные половые признаки отсутствуют, при мозаицизме могут быть выражены в разной степени. Типичные признаки кроме низкого роста: короткая шея, крыловидные кожные складки на шее, широкая грудная клетка, низкая линия роста волос, половой инфантилизм, первичная аменорея, бесплодие. Возможно поражение сердечно-сосудистой системы (коарктация аорты, дефект межжелудочковой перегородки, гипер-тензия), аномалии мочевой системы. В 16 % случаев полной моносомии X обнаружено снижение умственного развития. Для подтверждения диагноза необходимо исследовать половой хроматин, кариотип больного. Другим синдромом, близким по фенотипу к синдрому Шерешевского-Тернера, является синдром Нонне, при котором наряду с низкорослостью и крыловидными складками на шее, врожденными пороками сердца и почек обнаруживаются выраженные дисморфии лица (птоз, гипертелоризм, экзофтальм, микрогнатизм). Кариотип при этом синдроме нормальный, болеют как мальчики, так и девочки. Нанизм возникает также и в результате поражения костной системы. Для некоторых заболеваний этой группы установлен наследственный характер, этиология других до конца не выяснена. К этой группе относятся хондродистрофия, синдром Эллиса-Ван-Кревельда, остеохондродистрофия, несовершенный остеогенез, врожденная эпифизарная точечная дисплазия, фиброзная остеодисплазия, нейрофиброматоз Реклингхаузена и некоторые формы мукоролисахаридоза. При хондродистрофии больные отличаются карликовым непропорциональным ростом, ведущим симптомом является укорочение конечностей в основном за счет проксимальных отделов. Туловище сохраняет нормальные возрастные размеры, хотя позвоночник лишен нормальных изгибов. При рентгенологическом обследовании обнаруживаются узурированные эпифизарные хрящи, дистрофия метафизов, смещенность эпифизов. Среди причин низкорослости следует также отметить наследственные рахитоподобные заболевания (фосфат-диабет, болезнь и синдром де Тони-Дебре-Фанкони, почечный тубулярный ацидоз — синдром Батлера-Олбрайта, проявляется в дошкольном возрасте, чаще наблюдается у девочек (70 %); синдром Лоу, встречающийся лишь у мальчиков и характеризующийся мышечной гипотонией, врожденной катарактой, метаболическим ацидозом). Дифференциальный диагноз основных форм задержки роста представлен в табл. 80. Диагностика соматотроп-ной недостаточности основана на исследовании суточной спонтанной секреции гормона роста, определении концентрации ИФР-1 (соматомедин-С) и ИФРСБ-3, экскреции СТГ с мочой и пика выброса СТГ на фоне стимуляции. Для проведения первого из данных исследований требуется наличие специальных насосных систем, позволяющих каждые 20 мин в течение суток получать пробы крови. Этот метод очень информативен, но не используется пока как рутинный в клинической практике. Второй метод весьма эффективен для скрининга перед проведением провокационных проб (при нормальном уровне ИФР-1 и ИФРСБ-3 вопрос о соматотропной недостаточности не стоит, при сниженных цифрах ИФР-1 необходимо подтверждение путем постановки провокационных проб). Экскреция СТГ с мочой Дифференциальный диагноз основных форм задержки роста
у здоровых детей значительно превышает таковую у пациентов с дефицитом гормона роста. Однако и этот метод пока не стал рутинным. Уровень гормона роста выше 10 нг/мл в случайно взятой пробе сыворотки крови исключает его недостаточность, однако при более низком уровне обследование следует продолжить. Гормон роста следует определять после ряда физиологических и фармакологических стимулирующих (провокационных) воздействий. В норме реакция на стимуляцию проявляется увеличением содержания гормона роста выше 10 нг/мл, иногда его уровень может повышаться до 30 нг/мл. Чтобы результаты были достоверными, нужно убедиться, что состояние ребенка эутиреоидное, что у него нет серьезных сопутствующих хронических заболеваний или психосоциальной угнетенности. Одновременное тестирование других гипофизарных функций включает: определение ТТГ и функции щитовидной железы, АКТГ, кортизола и гонадотропных гормонов, поскольку дефицит гормона роста может быть связан с общей гипофункцией гипофиза. К физиологической стимуляции относятся погружение в сон и физическая нагрузка. Уровень гормона роста в сыворотке крови, взятой после интенсивных физических упражнений в течение 20 мин, у большинства здоровых детей повышен. Он повышается и через 45—90 мин после засыпания. Эти тесты информативны только для скрининга. Чаще для диагностики дефицита гормона роста используется фармакологическая стимуляция (табл. 81). Весьма важны клинические показания к проведению стимуляционных проб: скорость роста менее 4 см в год; SDS роста (коэффициент стандартного отклонения от 50-й процентили роста здоровых детей) менее 25; задержка костного возраста более 2 лет. Можно применять различные препараты (L-дофа, аргинин, инсулин, клофелин). При всех пробах необходимо воздержание от пищи на протяжении ночи. Если при фармакологической стимуляции не увеличивается содержание гормона роста свыше 7—10 нг/мл при всех исследованиях, это является доказательством классического дефицита гормона роста. Нужно проделать не менее двух тестов для подтверждения соматотропной недостаточности. Все пробы являются врачебной процедурой, так как возможны серьезные побочные эффекты. В диагностике дефицита гормона роста исследование соматомедина-С является предположительным, но не окончательным подтверждением генеза нарушений роста. В целом концентрация соматомедина-С снижается при гипопитуитаризме и повышается при акромегалии. Нормальный уровень соматомедина-С обычно указывает на неизмененную выработку гормона роста и может использоваться для скрининга, но для постановки окончательного диагноза не заменяет определение гормона роста после стимуляции. Низкий уровень соматомедина-С может указывать на дефицит гормона роста, но иногда он бывает связан с голоданием, хроническими заболеваниями и гипотиреозом. Лекарственные препараты, используемые в тестах на адекватность секреции СТГ
Тот факт, что содержание соматомедина-С не меняется в [ течение дня, в отличие от уровня гормона роста, делает определение ИФР-1 весьма информативным. Впрочем, уровень соматомедина-С варьирует с возрастом (очень низкий до 6 лет), и это обусловливает ограниченность применения данного исследования в клинической практике. Нормальное содержание соматомедина-С (ИФР-1)
Для одновременной оценки нескольких гипофизарных функций удобно проводить комбинированные тесты с различными гипоталамическими рилизинг-гормонами (в частности, инсулин + тиролиберин + люлиберин + кортиколиберин). Алгоритм исследования при низкорослости приведен на схеме 11.
Алгоритм мониторинга детей при низкорослости СЕМИОТИКА ВЫСОКОГО РОСТА. Обычно чрезмерный рост у детей заставляет родителей обращаться за помощью в пучаях сопутствующих отклонений от нормы в виде утомляемости, частых заболеваний, нарушений полового развития и др. При их отсутствии ускоренный рост редко является причиной пя беспокойства. Чаще всего, если не считать генетически высоких людей, у детей наблюдается конституциональное ускорение роста. У таких детей ускоряются созревание костей, рост и рано наступает пубертатный период. Конституционально высокие люди пропорционально сложены, у них отсутствуют признаки повышенного внутричерепного давления. Ожирение в препубертатном возрасте может привести к ускоренному росту, однако это явление временное; дети могут эыть высокими, но не достигают гигантского роста. При открытых зонах роста избыток гормона роста у детей триводит к развитию гигантизма, а не акромегалии, как у взрослых, однако признаки акромегалии бывают и при гигантизме даже у детей и подростков, а после закрытия эпифизов акромегалия становится более выраженной. Избыточная продукция соматотропного гормона может привести к ускоренному росту ребенка при каких-либо процессах (гидроцефалия, перенесенный энцефалит), стимулирующих активность гипоталамо-гипофизарной области. В этом случае гигантизм может развиться в любом возрасте, но наиболее часто ускорение роста начинается в дошкольном или школьном возрасте. Для этих детей характерны легкая утомляемость, пониженная сопротивляемость к инфекциям, нескладность фигуры, слабое развитие мускулатуры, при внимательном осмотре можно обнаружить акромегалоидные черты. Гипофизарный гигантизм встречается редко. Его причиной чаще всего является эозинофильная аденома, описаны случаи гигантизма и при опухоли гипоталамуса. У двух мальчиков с синдромом Олбрайта и ускоренным ростом были обнаружены функционирующие опухоли гипофиза; уровень СТГ у них был значительно повышен и не снижался при нагрузке глюкозой. В ряде случаев гигантизм и акромегалия могут начинаться как гипоталамические нарушения, которые приводят к гипертрофии и гиперплазии, а в итоге и к опухолевидному разрастанию соматотропных клеток. Гамартомы гипоталамуса (ганглиоцитомы) способствуют развитию акромегалии, секретируя рилизинг-фактор гормона роста. Другие опухоли, особенно исходящие из поджелудочной железы, вызывают акромегалию, вырабатывая рилизинг-гормон. В большинстве случаев ускоренный рост становится очевидным в пубертатный период, но может проявиться уже в возрасте 5 лет. Конечный рост иногда достигает 250 см и более. Часто необычно высокими для своего возраста (младший детский и начальный школьный) бывают дети с преждевременным половым развитием, но они не становятся гигантами, так как у них рано закрываются зоны роста и рост прекращается. Высокорослых нелеченных больных тиреотоксикозом, гипогонадизмом или с синдромом Марфана (арахнодактилия) легко отличить по клиническим признакам этих заболеваний, а уровень соматотропного гормона у них нормальный. В основе развития синдрома Клаинфелтера лежит хромосомная аберрация с наличием лишней Х-хромосомы (47,XXY, 48,XXYY, 48,XXXY и др.). Больные мальчики высокого роста с непропорционально длинными конечностями, в детстве они отличаются хрупким телосложением, а в старшем возрасте у них развивается ожирение. Отличительным признаком синдрома является гипоплазия яичек и полового члена. Вторичные половые признаки развиты плохо, могут наблюдаться оволосение по женскому.типу, гинекомастия (50 % случаев). Отставание психического развития, наблюдаемое у больных, связывается с избыточной Х-хромосомой (чем их больше в кариоти-пе, тем выше вероятность психического отставания). Гигантизмом, сопровождающимся повышенным уровнем СТГ, страдают некоторые больные липодистрофией, но для них характерно отсутствие подкожно-жировой клетчатки; появляется все больше данных о нарушении функции гипоталамуса при этом заболевании. Церебральный гигантизм (синдром Сотоса) встречается значительно чаще гипофизарного и характеризуется быстрым ростом, но уровень соматотропина в сыворотке крови остается в пределах нормы, а комплекс данных свидетельствует о том, что в основе патологии лежат мозговые нарушения. В большинстве случаев рост и масса больного превышают 90-ю процентиль, возможна макрокрания. Ребенок быстро растет, и к возрасту 1 года длина его тела превышает 97-ю процентиль. Ускоренный рост продолжается в течение 4—5 лет, а затем ребенок растет с нормальной скоростью. Пубертатный период наступает в обычные сроки или несколько раньше. Характерны большие кисти и стопы с утолщенным слоем подкожно-жировой клетчатки. Голова большая, долихоцефалической формы, нижняя челюсть выступает вперед, глаза широко расставлены, больной неловок, походка его неуклюжа, координация движений нарушена. Эти признаки почти всегда сопровождаются отставанием умственного развития, варьирующим по степени, но не прогрессирующим. На рентгенограмме определяются большой череп, высокая крыша глазниц, не измененное, но несколько наклоненное кзади турецкое седло и увеличенное расстояние между глазницами. Нередко выявляются изменения на электроэнцефалограмме и расширение желудочков мозга. Клинический алгоритм мониторинга высокорослых детей представлен на рис.
Алгоритм мониторинга высокорослых детей Синдромы, сопровождающиеся увеличением размеров тела и быстрым ростом: 1) генетически обусловленные; Оценка лабораторных показателей при различных формах нарушений роста
В табл.приведена оценка лабораторных показателей при различных формах нарушений роста. СЕМИОТИКА ЗАБОЛЕВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ. Основная функция щитовидной железы (ЩЖ) — синтезировать гормоны тироксин (Т4) и 3, 5, З-трийодтиронин (Т3). Исходными продуктами биосинтеза тиреоидных гормонов служат аминокислота тирозин и йод. Суточная потребность в йоде составляет 75—150 мкт. Йод поступает в организм в основном через желудочно-кишечный тракт с пищей и водой в виде йодидов и органических соединений. Ткань щитовидной железы обладает сродством к йоду и способна его захватывать против градиента концентрации, транспортировать и концентрировать в фолликулах, чтобы затем включать в биосинтез тиреоидных гормонов. Прежде чем захваченный йодид вступит в реакцию с тирозином, он должен окислиться до молекулярного йода под воздействием тиреоидной пероксидазы. Клетки щитовидной железы продуцируют также специфический тиреоглобулин — протеин, содержащий примерно 120 остатков тирозина. В результате йодирования тирозина образуются монойодтирозин и дийодтирозин; затем ассоциируются две молекулы дийодтирозина, образуя Т4, или одна молекула дийодтирозина с молекулой монойодтирозина, образуя Т3. Образовавшиеся гормоны находятся в составе тирео-глобулина в просвете фолликула (коллоид) в качестве резервной формы, поступая по мер физиологической потребности. Из тиреоглобулина под влиянием активированных протеаз и пептидаз высвобождаются Т3 и Т4. Тироксин является основным из гормонов, продуцируемых щитовидной железой. Трийодтиронин метаболически в 3—4 раза активнее, чем Т4. Лишь 20 % циркулирующего в крови Т3 секре-тируются щитовидной железой, остальные 80 % образуются в результате дейодирования Т4 под влиянием тироксин-5-дейоди-назы в печени, почках и других периферических тканях. На долю Т3 приходится большая часть физиологического действия тиреоидных гормонов. Количество Т4 больше, чем Т3, но он слабо связывается с ядерными рецепторами, и его физиологическое действие преимущественно опосредовано превращением в Tj. Наряду с Т3 при дейодировании Т4 5'-дейодиназой а-кольца образуется неактивный реверсивный Т3(рТ.,). Циркулирующие в крови гормоны щитовидной железы (Т3, Т4) прочно связаны с ти-роксинсвязывающими белками, в основном с тироксинсвязы-вающим глобулином (ТСГ) — 75—80 %; меньшее значение име- ют тироксинсвязывающий преальбумин (ТСПА) — 15 % и альбумин — 5—10 %. Концентрация или связывающая способность ТСГ нарушаются при многих патологических состояниях; эти показатели следует принимать во внимание при интерпретации уровней Т4 и Т3. Регуляция функции щитовидной железы осуществляется на трех уровнях: гипоталамическом, гипофизарном и тиреоидном. Главным фактором регуляции функции щитовидной железы является тиреотропный гормон (ТТГ) — гликопротеин, продуцируемый и секретируемый передней долей гипофиза. Его действие на секрецию тиреоидных гормонов опосредовано активацией аденилатциклазы в клетках щитовидной железы. Выработку ТТГ стимулирует тиролиберин, который синтезируется гипоталамусом и секретируется в гипофиз. В случае сниженной продукции тиреоидных гормонов уровни в крови ТТГ и тиролиберина должны быть повышены. Избыток тиролиберина или ТТГ приводит к гипертрофии и гиперплазии клеток щитовидной железы, повышенному захвату ими йода и ускорению синтеза тиреоидных гормонов. Экзогенный тиреоидный гормон и его избыточный синтез тормозят продукцию ТТГ. Дальнейший контроль за уровнем циркулирующих гормонов щитовидной железы осуществляется на периферии. При многих заболеваниях, не связанных со щитовидной железой, снижена экстратиреоидная продукция Т3; активность тироксин-5-дейодиназы тормозят ряд факторов, в том числе голодание, хроническое недоедание, острые заболевания и прием некоторых лекарственных веществ. Концентрация Т3 может быть значительно сниженной при нормальных уровнях Т4 и ТТГ. К функциональным тиреоидным тестам относятся методы определения ТТГ, Т4 и Т3, а также рТ3, ТГ. В настоящее время используются методы радиоиммунного анализа (РИА). Наиболее чувствительными и точными методами определения функции щитовидной железы являются тест третьего поколения на ТТГ и тест на свободное содержание Т4 и Тг ТТГ считается наиболее чувствительным индикатором функции щитовидной железы. Уровни Т4, Т3 и рТ3 подвержены нормальным возрастным изменениям, поэтому при интерпретации результатов их определения необходимо учитывать возраст ребенка, особенно период новорожденное. В крови здоровых людей циркулирует определенное количество тиреоглобулина, а у детей с врожденным атиреозом его нет. Изменения уровня ТСГ клинически ничем не проявляются и не требуют лечения, однако могут служить источником ошибок при диагностике гипер- и гипотиреоза. Различные методы получения пространственного изображения щитовидной железы — ультрасонография, компьютерная томография, магнитно-резонансная томография, а также ра- диоизотопные методы, то есть сканирование с технецием или радиоактивным йодом, — используются для идентификации ее аномалий. Щитовидная железа захватывает, но не усваивает технеций. Исследование распределения технеция позволяет визуализировать железу, насыщенную контрастом, с выделением «горячих» и «холодных» зон. Это помогает в оценке функционального состояния узлов щитовидной железы, определяемых при пальпации. «Холодный» узел скорее может оказаться злокачественным, чем «горячий» или «теплый». У лиц с гипертиреозом сканирование с технецием позволяет дифференцировать различные причины гиперфункции. Болезнь Грейвса характеризуется повышенной активностью щитовидной железы, причем распределение технеция происходит равномерно, в то время как токсический мультинодулярный зоб сопровождается гетерогенным распределением технеция. Измерение распределения Ш1 или 1321 способствует дифференциации гипертиреоидных состояний, таких как болезнь Грейвса, токсический автономный узел, токсический мультинодулярный зоб, ТТГ-аденома гипофиза, трофобластная опухоль (поглощение йода обычно повышено), и различных форм тиреоидита (подострый тиреоидит, безболезненный тиреоидит), искусственного тиреотоксикоза, опухоли яичника, при которых гипертиреоз сочетается со снижением усвоения йода. В норме поглощение радиоактивного йода составляет 8—30 % и зависит от содержания йода в рационе. Компьютерная томография и магнитно-резонансная томография помогают в идентификации рецидивов или метастатических изменений при раке щитовидной железы, а также используются для выявления загрудинных форм зоба. Гипотиреоз (ГТ) обусловлен недостаточной продукцией ти-реоидных гормонов щитовидной железой. При первичном гипотиреозе (врожденном или приобретенном) патологический процесс локализуется в щитовидной железе (аплазия, гипоплазия ЩЖ, дефицит йода в организме матери, генетически детерминированные дефекты ферментных систем биосинтеза и метаболизма тиреоидных гормонов — первичный врожденный гипотиреоз; дефицит йода в рационе, воспалительное или иммунное поражение ЩЖ, струмэктомия — первичный приобретенный гипотиреоз). Процесс может локализоваться в гипофизе (снижение секреции ТТГ — вторичный гипотиреоз, который может быть у детей, перенесших родовую травму, менингоэнцефалит, травму головного мозга, может являться следствием опухолевого процесса — краниофарингиома и др.) или гипоталамусе (снижение секреции тиреотропин-рилизинг-фактора — третичный гипотиреоз). Как правило, эти нарушения являются симптомами различных заболеваний гипоталамо-гипофизарной системы. Синдром ГТ при этих состояниях (вторичном и третичном ГТ) часто сочетается с нарушениями роста и другими симптомами поражения центральной нервной системы и не является самостоятельным заболеванием. Дефицит тиреоидных гормонов обусловливает выраженные изменения метаболизма белков, жиров и углеводов, что приводит к нарушениям дифференцировки мозга (необратимые изменения мозга, если лечение начато после 4—6-недельного возраста) и интеллекта. Снижение синтеза белка, образования энергии, накопление в тканях муцина способствуют замедлению роста и дифференцировки скелета, снижению функции гладких и скелетных мышц, кроветворной системы, эндокринных желез, клеточного и гуморального звена иммунитета. Выделяются легкая, средняя и тяжелая (микседема) формы гипотиреоза. Клинические проявления ГТ зависят от возраста, в котором возникает недостаточность функции ЩЖ, ее степени и длительности. На первый план у детей при ГТ выступает задержка физического, умственного и полового развития. Она тем резче, чем раньше возникает заболевание — пропорционально степени дефицита тиреоидных гормонов. Врожденный или приобретенный ГТ у детей имеет сходную клиническую картину. И в том и в другом случае преобладает торможение всех функций организма: ослабление деятельности ряда органов, вялость обменных процессов и трофические расстройства. Этиологическая классификация гипотиреоза: - Недостаточность тиролиберина Самая частая причина врожденного гипотиреоза — нарушение развития ЩЖ (аплазия, гипоплазия, эктопия). Эктопирован-ные участки ЩЖ располагаются в промежутке между корнем языка и местом нормальной локализации ткани ЩЖ. Врожденный гипотиреоз может быть обусловлен разнообразными нарушениями биосинтеза тиреоидных гормонов. Отличительной особенностью этих нарушений является развитие зоба (зобогенный гипотиреоз). Частота зобогенного гипотиреоза составляет 1 случай на 30 000—50 000 живорожденных детей. Дефекты детерминированы генетически и в большинстве случаев наследуются по аутосомно-рецессивному типу. Среди детей с врожденным гипотиреозом девочек в 2 раза больше, чем мальчиков. До внедрения программ скрининга новорожденных врожденный гипотиреоз редко диагностировался в период новорожденное, так как в это время его симптомы еще не вполне развиваются. К ранним клиническим признакам заболевания относятся: большая масса тела при рождении (более 4000 г), пупочная грыжа, затянувшаяся «физиологическая желтуха», связанная с задержкой созревания системы конъюгации глюкуронидов, трудности при вскармливании (сниженный аппетит, затруднения при глотании, цианоз, приступы апноэ при кормлении), недостаточная прибавка массы тела, позднее отхождение мекония, склонность к запорам, большой живот, сонливость, вялость, низкий тембр голоса. Дыхательные нарушения, частично из-за большого языка, проявляются в виде эпизодов остановки дыхания, шумного дыхания, затрудненного носового дыхания. Кожа, особенно конечностей, холодная, влажная, возможен отек наружных половых органов и конечностей. Пульс медленный, нередко отмечаются шумы в сердце и кардиомегалия. Частым симптомом является анемия, устойчивая к лечению гематогенными препаратами. Симптомы гипотиреоза у новорожденных развиваются постепенно, особенно у находящихся на грудном вскармливании, поскольку в грудном молоке содержится много тиреоидных гормонов, в частности Т3, хотя и в недостаточном количестве для полной компенсации заболевания. Полная клиническая картина врожденного гипотиреоза развивается к возрасту 3—6 мес. Постепенно формируются типичные проявления микседемы: грубые черты лица, толстые губы, широкая переносица, широко расставленные глаза, узкие глазные щели, большой отечный язык, короткая шея. Кожа утолщена, желто-серого цвета, сухая и шершавая, ребенок мало потеет, подкожная клетчатка мик-седематозна. Волосы редкие, сухие, голос грубый, хриплый. Темп развития детей низкий, они отстают в росте, у них замедлено созревание костной ткани, поздно появляются зубы, они кажутся сонными, поздно начинают садиться, вставать на ноги. Ребенок с трудом узнает мать, речь у него развивается с большим опозданием и остается неправильной, запас слов ограничен. При отсутствии адекватного лечения возникают нарушения интеллекта, причем поражения мозга носят необратимый характер и прогрессируют вплоть до олигофрении. Вторичные половые признаки могут появляться поздно, вовсе отсутствовать или развиваться преждевременно. Основной обмен резко снижен, температура тела ниже нормы, пульс замедлен, АД снижено, ЭКГ — низковольтная. Для анализа крови характерны гиперлипидемия, гиперхолестеринемия, нормохромная анемия. При лабораторном исследовании уровней тиреоидных гормонов в крови наблюдается снижение уровнейJT (норма 110—225 нмоль/л) и Т3 (норма 2—4 нмоль/л), а уровень ТТГ (норма 1,5—6,0 мкЕД/мл) повышен при первичном и снижен при вторичном и третичном ГГ. Скрининг новорожденных проводится на 3—5-й день жизни и включает определение содержания Т4, но диагноз подтверждается определением ТТГ, обязательным для диагностики первичного гипотиреоза в любом возрасте. При низких цифрах ТТГ, возможно из-за нарушения функции гипофиза или гипоталамуса, показаны исследования со стимуляцией ти-ролиберином. Оценивая результаты исследований, следует строго учитывать возраст больного, особенно период новорожденное, и ориентироваться на соответствующие нормы. Диагностика различных форм гипотиреоза
Уровень тиреоглобулина в плазме крови будет неопределенно низкий при полном отсутствии ткани ЩЖ, при ее присутствии он всегда определяется. Для решения вопроса о наличии ткани ЩЖ показана сцинтиграфия. Приобретенный гипотиреоз может развиться у ранее эутирео-идного ребенка в силу самых различных причин. К гипотиреозу могут привести полная или субтотальная тиреоидэктомия в связи с тиреотоксикозом или раком ЩЖ, а также удаление аномальной железы, если она служит единственным источником тиреоидных гормонов. Внутриклеточное накопление цистина при нефропатическом цистинозе приводит к нарушению функции щитовидной железы и в конце концов к ее деструкции. Гипотиреоз может быть явным, но чаще — компенсированным. Непреднамеренное облучение области ЩЖ при лечении болезни Ходжкина и других злокачественных процессов приводит к нарушению ее функции у 1/3 детей и подростков. Гипотиреоз с зобом изредка развивается в результате хронических инфекционных процессов или длительного приема таких лекарственных веществ, как йодиды, кобальт и др. Однако приобретенный гипотиреоз чаще всего обусловлен лимфоцитарным тиреоидитом, который может быть как зобогенным, так и незобогенным. Клинические проявления зависят от возраста ребенка к началу заболевания и степени нарушения функции ЩЖ. Чем в более старшем возрасте заболевает ребенок, тем меньше гипотиреоз отразится на росте и развитии. Микседематозные изменения кожи, запоры, сонливость и снижение умственной активности возможны в любом возрасте. Гинертиреоз обусловлен наличием избыточного количества тиреоидных гормонов в организме. К механизмам, которые могут вызвать гипертиреоз, относятся: гиперфункция фолликулярных клеток щитовидной железы с избыточным синтезом и секрецией тироксина и трийодтиронина, деструкция фолликулярных клеток с высвобождением ранее синтезированных Т3 и Т4, прием в избыточных дозах синтетических тиреоидных гормонов или йодистых препаратов. Гиперфункция фолликулярных клеток ЩЖ может быть автономной или связана со стимуляцией тиреотропиновых рецепторов тиреотропным гормоном гипофиза или антителами к рецептору ТТГ. Автономная гиперфункция фолликулярных клеток ЩЖ редко наблюдается в детском возрасте и связана с токсической аденомой, гиперфункционирующей карциномой ЩЖ и гипертиреозом при синдроме Олбрайта. Стимуляция тиреотропиновых рецепторов антителами к рецептору ТТГ вызывает развитие диффузного токсического зоба (болезнь Грейвса), который является наиболее частой причи- ной гипертиреоза в детском возрасте (около 95 %). У детей, рожденных матерями, страдающими болезнью Грейвса, в период новорожденное возможен гипертиреоз в виде транзиторного феномена или классической болезни Грейвса. Гипертиреоз, связанный с избыточной секрецией тиреотро-пина, встречается редко и в большинстве случаев обусловлен секретирующей ТТГ опухолью гипофиза или резистентностью гипофиза к тиреоидным гормонам. Воспаление щитовидной железы вирусной или аутоиммунной природы (подострый тиреоидит, аутоиммунный тиреоидит Хашимото) вызывает повышенную деструкцию и поступление в кровь большого количества ранее синтезированных гормонов. Гипертиреоз при этом транзиторный и нетяжелый, обычно длится несколько недель или месяцев. Прием синтетических гормонов щитовидной железы может вызвать повышение уровня тиреоидных гормонов в крови. Прием или парентеральное введение йодидов также может привести к тиреотоксикозу. Диффузный токсический зоб (болезнь Грейвса) — органоспеци-фическое аутоиммунное заболевание, клинически проявляющееся увеличением щитовидной железы, гипертиреозом, инфиль-тративной офтальмопатией. Болеют в основном дети в возрасте 10—15 лет, чаще девочки (Д : М = 3:1; 5:1). Основная роль в патогенезе заболевания принадлежит образованию тиреоидстимулирующих иммуноглобулинов, которые связываются с рецепторами ТТГ, что усиливает синтез тиреоидных гормонов и ведет к увеличению щитовидной железы. Известно, что выработка тиреоидстимулирующих антител обусловлена антигенспецифическим дефектом клеточной супрессии. Ассоциация между HLA-DR3 и HLA-B8 отражает, как полагают, связь между этими антигенами и генами, контролирующими иммунный ответ на тиреоидную ткань. Болезнь Грейвса классифицируется как аутоиммунное поражение щитовидной железы. Некоторые случаи болезни Грейвса представляют собой часть более обширного аутоиммунного процесса, связанного с такими состояниями, как пернициозная анемия, витилиго, сахарный диабет, аутоиммунная надпочечниковая недостаточность и системная красная волчанка. Клиническое течение болезни Грейвса у детей весьма вариабельно, но не столь молниеносно, как это бывает у взрослых. Симптомы развиваются постепенно, и самыми ранними из них могут быть эмоциональная лабильность, сопровождающаяся двигательной активностью, повышенная возбудимость, впечатлительность, неустойчивость настроения, плаксивость. Иногда пациенты жалуются на расстройства сна, неспособность сосредоточиться и выраженную утомляемость при любой физической нагрузке. При вытянутых руках заметен тремор пальцев. Щитовидная железа увеличена, как правило, до II—III степени, имеет плотноэластическую консистенцию, реже — диффузно-узловую, при пальпации отмечается пульсация, при аускультации над ней выслушиваются сосудистые шумы. При загру-динном расположении железы могут быть симптомы сдавления органов шеи — изменение голоса, затруднение глотания, дыхания. Однако степень увеличения железы не определяет степени тяжести тиреотоксикоза. Кожа у больных гладкая, теплая, влажная от пота. Может быть повышение температуры до субфебрильных цифр. При сердечно-сосудистых нарушениях тахикардия является постоянным и ранним признаком, сохраняется во время сна, нарастает параллельно тяжести заболевания, пульс быстрый, систолическое АД повышено, диастолическое — снижено. Тоны сердца усилены, прослушивается систолический шум на верхушке сердца. При длительном течении заболевания и поздно начатом лечении развиваются дистрофия миокарда (расширение границ и ослабление тонов сердца, признаки относительной недостаточности митрального клапана), недостаточность кровообращения. В редких случаях выявляется фибрилляция предсердий. Синдром желудочно-кишечных расстройств характеризуется «волчьим» аппетитом, не сопровождающимся увеличением массы тела, ребенок даже худеет, появлением жажды, дисфункцией желудочно-кишечного тракта (дискинезия желчевыводящих путей, гастроптоз, пилородуоденоспазм, поносы), увеличением печени. Офтальмопатия при болезни Грейвса, которая развивается в результате аутоиммунно опосредованного воспаления глаз и ретроорбитальной зоны, может проявиться экзофтальмом с расширением глазных щелей (симптом Дальримпля), редким миганием (симптом Штелльвага), нарушением конвергенции (симптом Мёбиуса), отставанием движения верхнего века при взгляде книзу (симптом Грефе), усилением пигментации век (симптом Еллинека), отечностью век (симптом Зингера), тремором век (симптом Розенбаха) и др. Дети с гипертиреозом обычно высокие, окостенение скелета опережает хронологический возраст, но половое развитие не нарушено. При неблагоприятном течении диффузно-токсического зоба возможно развитие тиреотоксического криза. Возникновению его способствуют инфекционные заболевания, физическая нагрузка, стресс, струмэктомия, проводимая без устранения тиреотоксикоза. Криз проявляется острой гипертермией, резкой тахикардией, сердечной недостаточностью и двигательным беспокойством, может прогрессировать до бреда, комы и летального исхода. Другой вариант — «апатический», для него характерны чрезвычайное равнодушие, апатия, кахексия. Уровни Т4 и Т3 в плазме обычно повышены, а содержание ТТГ снижено, что иногда не поддается определению. У некоторых больных повышено только содержание Т3 при нормальном содержании Т4, что называется Т3-токсикозом. У большинства больных с впервые выявленной болезнью Грейвса повышен уровень тиреостимулирующих иммуноглобулинов, концентрация которых коррелирует с активностью заболевания. Уровень тиреоглобулина в сыворотке крови также повышен. Меньшее значение в диагностике заболевания имеют гипохолестеринемия, ти-полипидемия, лимфоцитоз, нарушение углеводного обмена с гипергликемией, изменения ЭКГ. Врожденный гипертиреоз связан с трансплацентарным переносом тиреостимулирующих иммуноглобулинов. Высокая концентрация тиреостимулирующих иммуноглобулинов в крови матери во время беременности с высокой вероятностью предсказывает гипертиреоз у новорожденного. Гипертиреоз у новорожденных обычно транзиторный и исчезает в течение 3 мес, изредка длится несколько лет; с одинаковой частотой болеют девочки и мальчики. Многие дети рождаются недоношенными, у большинства щитовидная железа увеличена. Ребенок чрезвычайно беспокоен, возбудим и гиперактивен. Глаза широко открыты и кажутся выпученными. Возможно резкое учащение пульса и дыхания, температура тела повышена. Уровень Т4 в сыворотке крови значительно повышен. Нередко отмечаются ускорение окостенения скелета, выбухание большого родничка, синостоз черепных швов. В случае краниосиностоза возможна задержка психического развития. Токсическая аденома щитовидной железы — доброкачественная опухоль ЩЖ, автономно продуцирующая тиреоидные гормоны независимо от контроля со стороны гипофиза. Заболевание преимущественно развивается у взрослых и редко в детском возрасте, сопровождается клиникой тиреотоксикоза. В связи с избыточной автономной продукцией тиреоидных гормонов подавляется тиреотропная функция гипофиза, что приводит к гипоплазии и снижению функции остальной ткани ЩЖ. Пальпаторно определяется округлый с гладкой поверхностью узел, подвижный при глотании, безболезненный при пальпации. Клиническая картина такая же, как и при диффузном токсическом зобе, за исключением экзофтальма, который при аденоме практически не встречается. При радиоизотопном исследовании ЩЖ (с использованием радиоактивного йода) определяется значительное поглощение радиоактивного вещества узлом («горячий» узел) при его пониженном захвате остальной частью железы. Гипертиреоз при синдроме Олбрайта также связан с одиночным или множественными гиперфункционирующими аденоматозными узлами в ЩЖ. Этот синдром характеризуется фиброз- ной дисплазией скелета с пятнистой пигментацией кожи и гиперфункцией эндокринных желез. Наиболее частым эндокринным нарушением является преждевременное половое развитие, но возможны также гипертиреоз, синдром Кушинга, гиперпа-ратиреоз, акромегалия. Гипертиреоз одинаково часто бывает у лиц обоего пола. Заболевание начинается в возрасте 3—12 лет. Уровень ТТГ в крови снижен, Т3 и Т4 — повышен. Гипертиреоз при аденоме гипофиза, секретирующей ТТГ, и при резистентности гипофиза к тиреоидным гормонам характеризуется повышением в крови концентрации Т^и Т3, а также нормальным или повышенным уровнем ТТГ (ТТГ-индуцированный гипертиреоз). Клинические проявления схожи с таковыми при болезни Грейвса. У пациентов с аденомой гипофиза могут быть жалобы, связанные со сдавленней опухолью перекреста зрительных нервов (атрофия зрительных нервов и изменения полей зрения по типу битемпоральной гемианопсии). У некоторых больных в крови повышены уровни соматотропного гормона, пролактина. При проведении пробы с тиролиберином уровень ТТГ в крови не изменяется при аденоме гипофиза; в случае резистентности гипофиза к тиреоидным гормонам наблюдается нормальный или повышенный ответ ТТГ на введение тиролиберина. Подострый тиреоидит (гранулематозный тиреоидит) — заболевание, по-видимому, вирусной этиологии, сопровождается образованием в щитовидной железе гранулем, содержащих гигантские клетки, у детей встречается редко. Начинается остро и сопровождается повышением температуры тела, ознобом, головной болью, общим недомоганием, болезненностью щитовидной железы. При исследовании крови СОЭ повышена, лейкоцитарная формула обычно не изменена. Симптомы тиреотоксикоза выражены умеренно, связаны с деструкцией фолликулярных клеток ЩЖ и выделением большого количества ранее синтезированных гормонов. Титр антител в начале заболевания обычно не повышен, но может транзиторно повышаться при выздоровлении. Гипертиреоз может развиться при аутоиммунном тиреоидите (тиреоидите Хашимото) в результате аутоиммунной деструкции клеток ЩЖ. У детей симптомы тиреотоксикоза умеренно выражены, щитовидная железа увеличена, плотной консистенции, может, быть болезненна. Уровни Т4 и Т3 повышены, ТТГ практически не определяется, уровень антител к тиреоглобулину, мик-росомальному антигену повышен, наблюдаются изменения в иммунограмме (снижение количества и активности Т-супрессоров, повышение количества и активности Т-хелперов, В-лимфоцитов). При радиоизотопном исследовании поглощение 3Ч при тиреотоксической стадии тиреоидитов снижено. СЕМИОТИКА НАРУШЕНИЙ ПОЛОВОГО РАЗВИТИЯ. Половое созревание — это период, в течение которого появляются вторичные половые признаки. Он четко не ограничивается по длительности, но обычно продолжается около 2—3 лет. Гипоталамус, гипофиз и гонады активно взаимодействуют на протяжении многих лет еще до появления вторичных половых признаков. В детском возрасте уровни фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) в крови низкие, но вполне поддаются определению, а в препубертатный период медленно повышаются. До начала пубертата очень небольшого количества половых стероидов достаточно для торможения секреции гормонов гипоталамусом и гипофизом. С началом пубертата гипоталамический «гонадостат» становится все менее чувствительным к тормозящему действию половых стероидов на секрецию гонадотропинов. В результате уровни ЛГ и ФСГ в крови повышаются, гормоны стимулируют гонады и устанавливается новый гомеостатический уровень (gonadarche). Полагают, что это снижение чувствительности гипоталамуса важно для начала пубертата. У девочек в этот период резкое увеличение продукции ФСГ предшествует увеличению концентрации в плазме эстрадиола; у мальчиков резкому повышению уровня тестостерона предшествует ускорение продукции ЛГ. Синергизм ФСГ и ЛГ способствует тем изменениям в гонадах, которые наблюдаются в этот период. Согласно другим данным, созревание гипофиза и гонад не имеет отношения к инициации пубертата, а в основе нейроэн-докринного запуска его лежит увеличение частоты и амплитуды импульсной секреции люлиберина с последующим изменением характера секреции гонадотропинов, преимущественно ЛГ. Первым проявлением этого процесса является увеличение секреции ЛГ в период сна. Это увеличение можно зафиксировать еще до каких-либо внешних проявлений пубертата. Затем увеличиваются частота и амплитуда выброса ЛГ в дневное время. К этому периоду секреторная способность гипофиза возрастает, что отражается на характере ответа ЛГ на экзогенно вводимый люлиберин. У девочек в середине или конце пубертатного периода, с началом овуляторных циклов, развивается механизм положительной обратной связи, благодаря которому повышение уровня эстрогена в середине цикла вызывает отчетливое увеличение, а не уменьшение секреции Л Г. До середины подросткового периода способность эстрогена высвобождать ЛГ не проявляется. В процессе полового созревания определенную роль играют также андрогены коры надпочечников (adrenarche). Уровни в крови дегидроэпиандростерона (ДГЭА) и дегидроэпиандростерона сульфата (ДГЭАС) начинают повышаться еще до появления самых ранних физикальных признаков, раньше увеличения концентрации гонадотропинов, тестостерона или эстрадиола (примерно в возрасте 6 лет), у девочек быстрее, чем у мальчиков. Время начала пубертата варьирует и больше коррелирует с костным возрастом, чем с хронологическим, а также определяется наследственными и средовыми факторами. Так, у занимающихся балетом, гимнастикой, плаванием, бегом и другими видами спорта девочек, у которых с раннего возраста сочетаются небольшая масса тела и высокая физическая активность, наступление пубертата и (или) появление менструаций нередко значительно задерживаются. Это подтверждает положение о возможной связи между массой и составом тела, физическими нагрузками, с одной стороны, и половым созреванием — с другой. У девочек в пубертатном периоде происходит перестройка организма, обусловленная главным образом эстрогенпродуци-рующей деятельностью яичников. Под постепенно усиливающимся влиянием гонадотропных гормонов ускоряется рост фолликулов. Растущие фолликулы, разной степени зрелости, секрети-руют все большее количество эстрогенов. Под их влиянием изменяется архитектоника тела, развиваются молочные железы, увеличиваются наружные и внутренние гениталии, изменяется структура эндометрия, слизистой оболочки влагалища. Рост волос на лобке и в подмышечных впадинах, наличие угрей и запах тела зависят от андрогенов. Начало физиологического пубертата имеет довольно широкие возрастные пределы. У 95 % здоровых девочек вторичные половые признаки начинают появляться с 8,5—13 лет, у 95 % здоровых мальчиков — в возрасте 9,5—13,5 лет. Начальным проявлением полового созревания у 85 % девочек является рост грудных желез (телархе), у 15 % начинают расти волосы на лобке. Первая менструация (менархе) обычно происходит спустя 18—24 мес после начала роста грудных желез (средний возраст — 12,8 лет, колебания от 10 до 16 лет). В первые 1—2 года после менархе циклы могут быть ановуляторными. Интенсивный рост тела у девочек (ростовой скачок около 25 см), в противоположность мальчикам, начинается рано, параллельно с увеличением молочных желез, и заканчивается с наступлением менархе. Половое развитие у мальчиков происходит постепенно и начинается с исчезновения подкожного жира в мошонке, появления ее пигментации и многочисленных мелких складок. Яички увеличиваются и опускаются на дно мошонки, начинается рост полового члена.- Оволосение лобка вначале имеет женский тип, ас 16—17 лет переходит к мужскому. Появляются волосы в ак-силлярных областях, пушок на верхней губе, щеках и подбородке постепенно заменяется стержневыми волосами. Изменяются размеры предстательной железы, начинает расти ткань молочной железы, соски приобретают коническую форму (юношеская гинекомастия), становятся больше, пигментируются околососковые кружки; спонтанная регрессия пубертатной гинекомастии наступает в течение нескольких месяцев, и лишь в редких случаях нагрубание сохраняется более 2 лет. Увеличивается гортань, происходит мутация голоса, часто появляются угри. Параллельно усиливаются процессы сперматогенеза, хотя полноценная репродуктивная функция формируется значительно позже — к 16—17 годам. Ростовой скачок (около 28 см) начинается в середине пубертатного периода и завершается в его конечной стадии. Половое созревание определяется при обследовании и описывается по шкале, разработанной Джоном Таннером в 1969 г. Стадии Таннера и оценка полового развития приведены в табл. 85—90. Выделяются пять стадий полового созревания: I соответствует препубертатному периоду, а V — состоянию, как у взрослого человека. Стадии полового развития по Таннеру
Классификация стадий полового созревания у девочек
Оценка стадии полового развития у девочек
Размеры матки и яичников у здоровых девочек в зависимости от стадии полового развития, поданным ультрасонографии
Классификация стадий полового созревания у мальчиков
Оценка стадии полового развития у мальчиков
В дополнение к объективному обследованию методами оценки стадии полового созревания являются определение костного возраста, скорости и типа роста и специальные эндокринологические обследования. Время появления рентгенологических признаков центров оссификации у детей разного возраста
Задержка пубертата — отсутствие любых признаков полового созревания у подростка, достигшего верхнего возрастного предела нормального пубертата. Это означает отсутствие увеличения тестикулярного объема (<4мл) у мальчиков к 14 годам и отсутствие увеличения молочных желез у девочек к 13 годам. Полное обследование необходимо проводить девочкам при отсутствии развития грудных желез в возрасте 13 лет и отсутствии менструаций в возрасте 15 лет. Мальчиков нужно обследовать в тех случаях, если у них длина яичек не достигает 2,5 см в возрасте 15 лет. Причины задержки полового созревания у детей обоего пола можно разделить на три основные группы. Первая, наиболее частая, — временная функциональная, или конституциональная, задержка созревания гипоталамо-гипофизарной области. Вторая причина — органические поражения гипоталамо-гипофизарной области, приводящие к снижению секреции гонадотропинов (ги-погонадотропный гипогонадизм). Третья причина — первичная гонадная недостаточность, приводящая к растормаживанию гонадотропной секреции (гипергонадотропный гипогонадизм). Задержка полового развития конституционального характера — самая частая причина нарушений пубертата у детей, ее можно рассматривать как крайний вариант нормы. Однако функциональные нарушения созревания гипоталамо-гипофизарной области могут быть обусловлены влиянием неблагоприятных экзогенных факторов (хронические заболевания, стрессы, физические и эмоциональные перегрузки и т. д.). Имеются сообщения о влиянии на течение пубертата мутантных форм ЛГ, обладающих более коротким периодом жизни. В общей популяции гомозиготное носительство аномальных форм Л Г составляет 3 %, а гетерозиготное — 26 %. Наличие аномального Л Г приводит к задержанному течению полового созревания и в дальнейшем может приводить к нарушению репродуктивной функции. С жалобами на задержку пубертата чаще обращаются мальчики (9:1), хотя частота встречаемости этого состояния одинакова для обоих полов. Это связано с большей психологической дезадаптацией мальчиков. Главная причина, заставляющая страдать подростка, — это задержка роста, так как ростовой скачок у мальчиков значительно отдален по времени от первого появления вторичных половых признаков. Гипогонадотропный гипогонадизм может встречаться как изолированно, так и в сочетании с другими вариантами гипофизар-ной недостаточности или нарушениями формирования ткани мозга. Синдром Каллмена — врожденное заболевание с аутосомно-доминантным или Х-сцепленным аутосомно-рецессивным типом наследования с различной степенью экспрессивности, чаще встречается у мальчиков. Основной характеристикой синдрома помимо гипогонадизма является аносмия вследствие агенезии ольфакторных долей. Ольфакторные доли являются местом внутриутробной закладки нейронов, секретирующих люлиберин, которые затем мигрируют в область гипоталамуса. Таким образом, агенезия ольфакторных зон приводит не только к аносмии, но и к гипоталамической форме гипогонадизма. Пангипопитуитарная недостаточность, при которой дефицит гонадотропинов сочетается с выпадением секреции соматотропного гормона (СТГ), ТТГ, АКТГ, часто бывает обусловлена опухолями ЦНС, разрушающими ткань гипофиза. Краниофарингиома — самая частая причина, приводящая к снижению гипофизарной функции у детей пубертатного возраста. Клиническая манифестация заболевания прежде всего связана с резким снижением скорости роста ребенка из-за уменьшения секреции СТГ. Достаточно рано выявляются симптомы несахарного диабета, гипотиреоз. При выраженном объеме опухоли развивается нарушение зрения, включая билатеральное сужение полей, связанное с давлением опухоли на оптическую хиазму. Гипогонадизм выявляется в подавляющем большинстве случаев, однако не является ведущим симптомом краниофарингиомы. Гипогонадотропный гипогонадизм в сочетании с другими проявлениями гипопитуитаризма может развиваться в результате лучевой терапии опухолей области головы и шеи, сопровождать такие генетические заболевания, как синдромы Прадера-Вилли, Лоуренса-Муна-Билля, тяжелые соматические и эндокринные заболевания. Гипергонадотропный гипогонадизм может развиваться в результате врожденных, генетически детерминированных поражений гонад (синдром Шерешевского-Тернера у девочек, синдром Клайнфелтера у мальчиков, тестикулярный дисгенез, ферментативные нарушения синтеза тестостерона). Приобретенный первичный гипогонадизм может быть результатом травматического повреждения гонад, воздействия лучевой терапии, инфекций, аутоиммунного процесса. Наибольшую сложность для диагностики представляют две формы задержанного пубертата — задержка полового созревания конституционального характера и изолированный ги-погонадотропный гипогонадизм, тогда как гонадные формы гипогонадизма легко диагностируются по резкому повышению ЛГ и ФСГ уже в раннем пубертатном возрасте (10—11 лет). Конституциональная задержка пубертата и гипогонадотропный гипогонадизм характеризуются одинаково сниженными уровнями гонадотропинов и половых стероидов. Одним из самых достоверных диагностических тестов, разделяющих эти два состояния, является тест с определением дневной и ночной секреции ЛГ. В период сна у детей с конституциональной задержкой полового созревания уровень ЛГ значительно выше даже при отсутствии каких-либо признаков пубертата. У детей с центральным гипого-надизмом никакой разницы между ночной и дневной секрецией Л Г не отмечено. Высокую диагностическую ценность имеет также тест с аналогами люлиберина 24-часового действия (нафаре-лином, бусерелином). Введение аналога стимулирует достоверный подъем Л Г через 6—8 ч у детей с конституциональной задержкой и не влияет на уровень ЛГ у детей с гипогонадотропным гипогонадизмом. Алгоритм мониторинга детей с нарушениями полового созревания приведен на рис.
Алгоритм мониторинга детей с нарушениями полового созревания Преждевременное половое развитие (ППР). Половое развитие определяется как преждевременное при появлении вторичных половых признаков до 8 лет у девочек и до 9 лет у мальчиков. Причины преждевременного полового развития: Истинное преждевременное половое развитие (зависимое от гонадотропинов) - Идиопатическое
Девочки - Изосексуальное развитие (феминизация) Мальчики - Изосексуальное развитие (маскулинизация) - Гетеросексуальное развитие (феминизация) - Частичное преждевременное созревание Выделяются две основные формы преждевременного полового развития: истинное (гонадотропинзависимое) и ложное (гонадотропиннезависимое) вследствие повышенной секреции половых стероидов гормонопродуцирующими опухолями половых желез и надпочечников. Истинное преждевременное половое развитие вызвано повышением выброса гонадотропных гормонов гипофиза (ЛГ, ФСГ) в результате первичного поражения ЦНС и гипоталамической области. Часто эта форма сочетается с выраженной неврологической симптоматикой. При отсутствии причин, вызывающих преждевременное половое развитие, оно считается идиопатическим. У девочек ППР встречается значительно чаще, чем у мальчиков (4:1), причем преобладают спорадические формы. Половое развитие может завершаться быстро или медленно; процесс созревания может стабилизироваться или даже регрессировать, чтобы позднее начаться вновь. Развитие может начаться в любом возрасте. Первый признак у девочек — развитие молочных желез, возможно одновременное оволосение лобка, но чаще оно появляется позднее. Затем развиваются наружные половые органы, появляются волосы в подмышечных впадинах и начинаются менструации. Ранние менструальные циклы могут быть не столь регулярными, как при своевременном половом созревании. У мальчиков при ППР увеличиваются половой член и яички, появляются волосы на лобке, возникают частые эрекции. Голос становится более низким, ускоряется рост. Сперматогенез бывает уже в возрасте 5—6 лет, и возможны ночные поллюции. Как у мальчиков, так и у девочек ППР сопровождается приростом длины и массы тела. Дифференцировка костей скелета ускоряется и соответствует степени полового развития. Это приводит к раннему закрытию зон роста, в результате конечный рост оказывается ниже, чем он мог бы быть при своевременном половом развитии. Рост примерно у 1/3 больных не достигает 152 см. Развитие зубов и интеллекта соответствует хронологическому возрасту. Уровни ФСГ и ЛГ в плазме могут быть высокими по отношению к возрасту больного. Однако у 50% больных показатели в пределах нормы. Повышенные уровни гормонов могут чередоваться с нормальными. Уровни в плазме тестостерона (у мальчиков) и эстрадиола (у девочек) обычно повышены в соответствии со стадией пубертата и костного возраста. Экскреция 17-кетостероидов с мочой остается в пределах нормы или слегка увеличена. Возможны изменения на ЭЭГ, свидетельствующие о первичной патологии нервной системы. Причиной ППР могут быть самые разнообразные поражения ЦНС. Все они сопряжены с рубцеванием, инвазией или сдав-лением гипоталамической области. Чаще всего встречаются пи-неаломы, глиомы зрительных нервов, тератомы, располагающиеся над турецким седлом, нейрофибромы, астроцитомы и эпиндимомы. ППР сопровождаются и гипоталамические гамар-томы. Гамартома представляет собой доброкачественную эктопию ткани мозга, в 70% случаев она содержит нейросекре-торные гранулы люлебирина (ЛГ-рилизинг-гормон). Эктопия вызвана нарушением миграции секретирующих люлиберин нейронов в период эмбриогенеза, что приводит к их локализации вне гипоталамуса. Они могут функционировать автономно, сек-ретируя люлиберин, который, в свою очередь, стимулирует секрецию гонадотропинов. Дети с гамартомой имеют очень раннее начало ППР. Для девочек характерно раннее (до 3 лет) начало менструаций, носящих регулярный характер. У больных отмечается выраженная неврологическая симптоматика, могут быть судорожные абсансы в виде насильственного смеха. Для гормонального статуса детей с гипоталамической гамартомой характерны высокие, соответствующие зрелому пубертату, значения ЛГ и ФСГ, а также выраженный подъем ЛГ на стимуляцию ЛГ-рилизинг-гормоном, соответствующий характеру ответа у взрослых людей. Внутричерепные опухоли (герминомы) вызывают преждевременное половое развитие у мальчиков, секретируя хорионический гонадотропин, стимулирующий клетки Лейдига в яичках. Секретирующая хорионический гонадотропин герминома у девочек не вызывает ППР, так как отсутствует ФСГ. При опухолях печени (гепатобластоме, гепатоме) ППР возникает в результате продукции опухолевыми клеткамихорионического гонадотропина. Другие опухоли (хор и о- и тератокарциномы или тератома) также могут секретировать хорионический гонадотропин и спровоцировать ППР. Опухоли локализуются в ЦНС, средостении или половых железах. Чаще они встречаются у мальчиков (21 на 100), чем у девочек (2 на 100). Опухоли средостения свойственны мальчикам с синдромом Клайнфелтера. В сыворотке больных содержатся хорионический гонадотропин и альфа-фетопротеин в большом количестве, уровень ФСГ снижен, а ЛГ повышен вследствие перекрестного реагирования с хорионическим гонадотро-пином. При нелеченном гипотиреозе половое созревание у детей обычно задерживается и начинается не ранее того момента, когда костный возраст соответствует 12—13 годам. Однако возможно и преждевременное изосексуальное развитие (синдром Вик-Грамбаха), опережающее процесс окостенения. Половое развитие обычно проявляется ростом молочных желез у девочек и увеличением яичек у мальчиков. В то же время характерные для пубертатного периода изменения секреции андрогенов корой надпочечников выражены слабо, о чем свидетельствует скудное оволосение лобка и подмышечных областей или полное его отсутствие. Менструальные кровотечения могут быть даже при минимально развитых молочных железах. Уровень в плазме ТТГ резко повышен; по неизвестной причине в избытке секретируются также пролактин, ЛГ и ФСГ. При синдроме Рассела-Сильвера также может наблюдаться преждевременное половое созревание. Синдром Олбрайта — сочетание фиброзной диспла-зии скелета с пятнистой пигментацией кожи и эндокринными нарушениями. Из эндокринных нарушений чаще всего наблюдается преждевременное половое развитие, но возможны также гипертиреоз и кушингоидный синдром. Среди больных большинство составляют девочки. Ранее считалось, что эндокринные нарушения при этом синдроме связаны с патологией гипотала-могипофизарной области, однако в настоящее время доказана автономная гиперфункция периферических желез-мишеней. У девочек выявляются низкие допубертатные значения ЛГ и ФСГ, как базальные, так и стимулированные люлиберином, при чрезвычайно высоком уровне эстрадиола. Не выявляется также характерный для пубертата подъем ЛГ в ночное время. У многих больных девочек при ультразвуковом исследовании обнаруживаются кисты яичников; уровень эстрадиола при этом коррелирует с размерами кист. В более позднем возрасте у некоторых больных могут быть признаки истинного полового созревания; это подтверждается тем, что ранний псевдопубертат способствует активации гипоталамо-гипофизарной системы. У некоторых детей, которым поздно начато лечение врожденной дисфункции коры надпочечников, развивается клиника истинного преждевременного полового развития. Чаще это происходит, если костный возраст к началу терапии соответствует пубертатному — 12—14 годам. П р и семейной форме мужского типа П П Р (тестотоксикоз) наблюдаются гиперплазия интерстици-альных клеток Лейдига, иногда в виде аденоматозных узелков, и созревание сперматогенного эпителия. Заболевание генетически детерминировано и передается от больных мужчин и здоровых женщин по аутосомно-доминантному типу с проявлением только у лиц мужского пола, хотя встречаются и спорадические формы. Заболевание начинается рано (средний возраст 1,3+1,2 года) и сопровождается быстрыми темпами маскулинизации и костного созревания. При гормональном исследовании выявляются низкие базальные и стимулированные (ЛГ-рилизинг-гормоном) уровни гонадотропинов, низкие их суточные колебания на фоне высоких, соответствующих половозрелому возрасту показателей тестостерона. По мере роста ребенка возможно восстановление гипоталамо-гипофизарного контроля гонадной функции, то есть переход гонадотропиннезависимой формы ППР в гонадотропин-зависимую. Основной причиной ложного преждевременного полового развития у детей обоего пола являются гормонально-активные опухоли гонад или надпочечников. Кроме того, к ложному преждевременному половому tospeBaHHio следует отнести и вирильные формы врожденной дисфункции коры надпочечников. Яичники и тестикулы способны продуцировать и мужские и женские половые гормоны, таким же образом и гормонально-активные опухоли гонад способны продуцировать оба вида гормонов у детей обоего пола. В зависимости от преобладания тех или иных половых стероидов гормонально-активная опухоль может вызвать клинику преждевременного полового созревания по изосексуальному (свойственному полу ребенка) или гетеросексуальному (свойственному противоположному полу) типу. Гормонально-активные опухоли яичника— эстрогенпродуцирующие, главным образом из гранулезоклеточ-ной ткани, реже — высокодифференцированные формы тератом, секретирующие большое количество эстрогенов, — чаще встречаются у девочек в возрасте до 4 лет. Характерный и нередко первый клинический симптом — ациклические менструаль-ноподобные выделения. Вторичное оволосение развито слабо. Наружные гениталии резко эстрогенизированы. В крови и моче выявляется высокий уровень эстрогенов. Гормонально-активные андрогенпродуцирующие опухоли яичника (арренобластомы) встречаются у девочек старшего возраста. Их клиническое проявление обусловлено избыточным количеством андрогенов в организме. Развивается картина вирильного синдрома. В пубертатном возрасте у девочек прекращаются или не наступают менструации, атрофируются молочные железы, развивается оволосение по мужскому типу, грубеет голос, гипертрофируется и вирилизируется клитор. При обследовании выявляются высокий уровень тестостерона, повышенная экскреция с мочой 17-кетостероидов, хотя не в такой степени, как при гормонопродуцирующих опухолях надпочечников. Основным диагностическим методом является ультразвуковое исследование малого таза. Гормонально-активные опухоли яичек (андробластомы и интерстициалъноклеточные опухоли) встречаются относительно редко. Андробластома чаще бывает доброкачественной, но описано и ее злокачественное перерождение. Наибольшей гормональной (андрогенной) активностью обладает диффузный тип опухоли. Для него характерны отчетливые эндокринные проявления: значительная маскулинизация, иногда истинная гинекомастия. При развитии опухоли в основном из тубулярных эпителиальных элементов можно ожидать эстрогенного эффекта, тем более что андроге-ны и эстрогены могут трансформироваться друг в друга. Врожденная гиперплазия коры надпочечников (адреногенитальный синдром) чаще всего обусловлена недостаточностью 21-гидроксилазы. Известны две классические формы болезни: сольтеряющая и простая вирили-зирующая. У девочек врожденная гиперплазия надпочечников приводит к женскому псевдогермафродитизму. Нарушение сте-роидогенеза проявляется на ранних стадиях развития плода, поэтому признаки маскулинизации в той или иной степени уже выражены при рождении: увеличение клитора, более или менее выраженное слияние половых губ, урогенитальный синус. Внутренние половые органы не отличаются от таковых у здоровых девочек. После рождения маскулинизация прогрессирует. Преждевременно растут волосы на лобке, в подмышечных впадинах, грубеет голос, больные девочки выше своих сверстниц, костный возраст опережает хронологический, у них хорошо развита мускулатура. Если не проводится соответствующее лечение, грудные железы не развиваются и менструаций нет. При сольтеряю-щей форме вирилизация выражена в большей степени, чем при варианте без потери соли. У мальчиков при сольтеряющей форме адреногенитального синдрома появляются рвота, шок и электролитный дисбаланс в возрасте 7—10 дн. У лиц мужского пола без признаков избыточного выведения соли из организма нарушение проявляется признаками преждевременного изосексуального развития. При рождении ребенок выглядит нормальным, но признаки преждевременного полового и соматического развития могут проявиться уже на первом полугодии жизни или развиваются более медленно и становятся очевидными только в возрасте 4—5 лет и позднее. К числу таких признаков относятся: увеличение полового члена, мошонки, появление волос на лобке, угри, запах пота, понижение тембра голоса. Яички нормального размера, но по сравнению с увеличенным половым членом кажутся маленькими. Мышечная система хорошо развита, костный возраст опережает хронологический. Умственное развитие не страдает, но из-за особенностей физического развития возможны аномалии поведения. Преждевременное закрытие эпифизов приводит к раннему закрытию зон роста и в итоге к низкоросл ости. Алгоритм мониторинга детей с ускоренным половым созреванием приведен на рис.
Алгоритм мониторинга детей с ускоренным половым созреванием Существуют неполные формы преждевременного полового созревания. Преждевременное thelarche — изолированное развитие молочных желез у девочек в возрасте до 8 лет без других признаков полового созревания. Чаще всего начинается в первые 2 года, а в 1/3 случаев грудные бутоны присутствуют с рождения. Иногда увеличивается только одна железа или одна увеличивается больше другой. У 50 % детей железы регрессируют в течение 2 лет, у остальных сохраняются до возраста 5 лет и старше. Преждевременное thelarche — процесс обычно доброкачественный; в' некоторых случаях это семейный признак и может быть результатом повышенной чувствительности тканей грудных желез к нормально низкому уровню эстрадиола в препубертатном возрасте. Рост и окостенение скелета не нарушены, менструации наступают в обычные сроки. Уровни ФСГ и ЛГ в плазме обычно соответствуют норме, однако реакция на введение люлиберина может быть повышена, уровень эстрадиола — в пределах нормы или незначительно повышен. Преждевременное thelarche может быть признаком начала истинного полового созревания или псевдопубертата. Оно может быть обусловлено медикаментозным лечением или другим экзогенным воздействием эстрогенов. Преждевременное adrenarche — изолированный рост волос на лобке и в подмышечных областях при отсутствии других признаков полового созревания у девочек в возрасте до 8 лет и у мальчиков до 9 лет. У девочек оно бывает значительно чаще, чем у мальчиков. Волосы вначале появляются на половых губах, затем на лобке и, наконец, в подмышечных впадинах. Тогда же появляется запах пота, свойственный взрослым. При обследовании детей можно отметить некоторое ускорение линейного роста и дифференцировки костного скелета (в пределах 1—2 лет). Уровни гонадотропных гормонов и основных половых стероидов не превышают возрастную норму. Появление вторичных половых признаков подобно преждевременному наступлению пубертата может быть вызвано разнообразными лекарственными препаратами (прием эстрогенов, введение анаболических стероидов, примеси половых гормонов в пищевых продуктах, витаминных препаратах). Через кожу могут всасываться эстрогены, содержащиеся в косметических средствах. Экзогенные эстрогены вызывают интенсивное темно-коричневое окрашивание ареолы молочной железы, что обычно не встречается при эндогенных типах преждевременного развития. Преждевременно появившиеся признаки исчезают с прекращением введения экзогенных гормонов. Поделитесь этой записью или добавьте в закладки |
Полезные публикации |
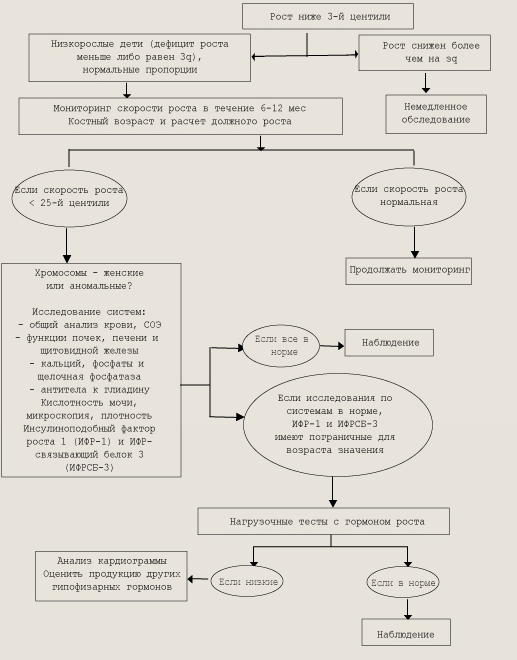
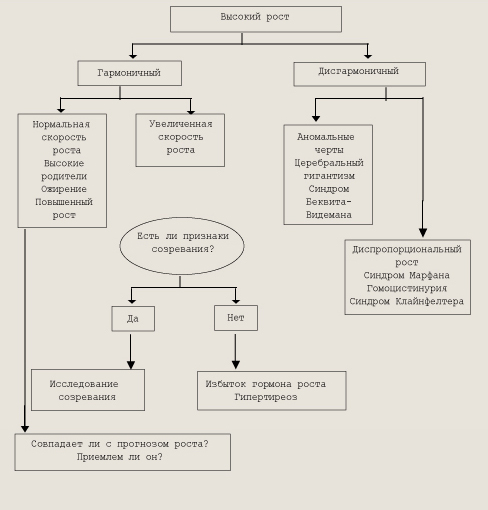
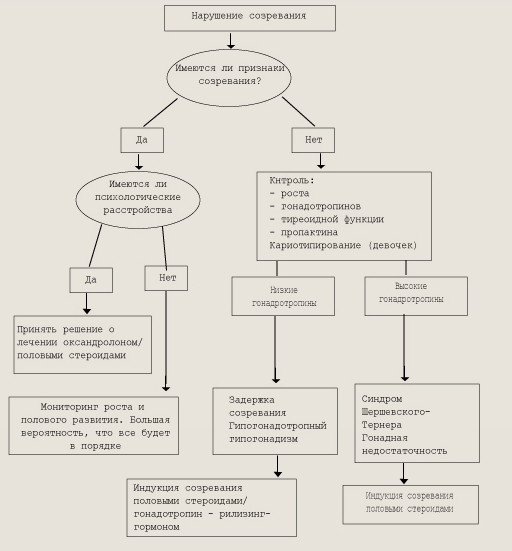
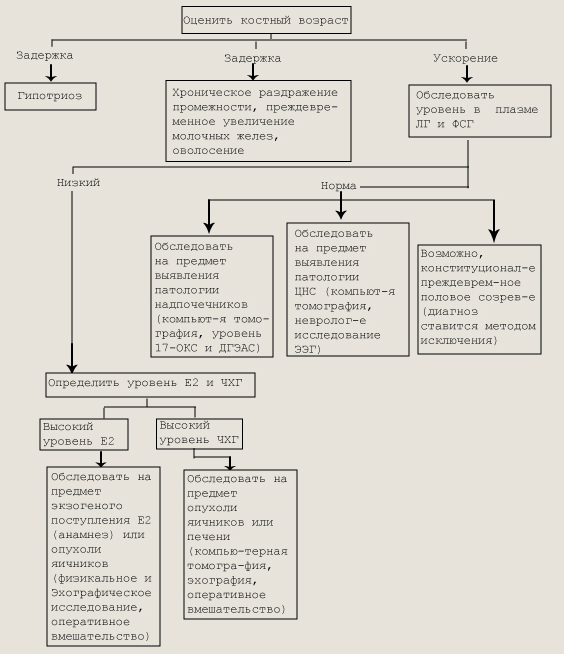
 Главная
Главная